Нитраты на войне. Часть II. Горький мёд и почти детективная история

Следующая попытка укрощения дьявола взрывчатки была связана с применением производных двух внешне похожих, но фактически абсолютно различных производных бензола: фенола и толуола.
История истинных нитропроизводных углеводородов, а не нитроэфиров спиртов, началась с изучения влияния концентрированной азотной кислоты на углеводороды. И хотя взаимодействие концентрированной азотной кислоты с органическими веществами (в частности, с алканами) не было тайной, условия их протекания и свойства нитросоединений долгое время оставались «терра инкогнита» для химиков. Вторым фактором, который сдерживал широкое их применение, была слабость сырьевой базы для их крупнотоннажного синтеза.
Не отходы, а ценное сырье
Ситуация начала меняться к концу XIX века. Связано это было с разработкой нефтяных месторождений и проблемой использования отходов коксового производства. Вот тут-то и оказалось, что иногда вредные отходы могут в одночасье превратиться в ценнейшее сырьё. Как оказалось, исходные продукты для получения ароматических нитропроизводных содержатся практически исключительно в каменноугольной смоле и встречаются как побочный продукт производства светильного газа.
Перед извлечением необходимых веществ каменноугольную смолу на месте подвергали первичной переработке, в результате которой получали четыре основных фракции: легкое масло, среднее или фенольное масло, тяжелое масло и антраценовое масло. Наибольшую ценность представляет легкое масло, которое составляет около 4% от общего количества смолы. При вторичной перегонке из него получают бензол (около 0,8%), толуол (около 1,7%) и фенол (0,4%). Кроме того, фенол получают синтетически из бензола и выщелачиванием надсмольных вод коксового производства.
Итак, первый шаг был сделан. А вот далее история производства двух основных ВВ того времени стала напоминать довольно сложный детектив, в котором действующие лица и участники, в лучших традициях жанра, напускали туман и придумывали самые разные кодовые имена.
Взрывчатая краска (пикриновая кислота)
Трудно сказать, кто и когда впервые получил пикриновую кислоту. Уже много веков назад было замечено, что при действии «духа селитры» (азотной кислоты) на многие органические соединения образуется желтая краска. Обычно честь получения пикриновой кислоты приписывается англичанину Вульфу, который в журнале Лондонского Королевского общества в 1771 голу сообщил, что с помощью индиго, обработанного азотной кислотой, можно красить ткани в желтый цвет (её сначала так и назвали — «жёлтое вещество», и только потом она получила название от греческого корня «пикрос» — «горький»). Однако соли пикриновой кислоты еще столетием раньше были известны Иоганну Глауберу. Иногда утверждают, что пикриновая кислота в течение долгого времени будто бы считалась безобидным красителем, и только много лет спустя случайно обнаружились ее взрывчатые свойства, но это не так: уже в 1799 году французский ученый Вельтер указал на способность пикриновой кислоты к взрыву совершенно недвусмысленно.
Правда, взрывалась она не так, чтобы очень легко, и поэтому долгое время первоисследователи «пикринки» упорно изучали ее другое, более актуальное для того времени свойство — способность быть прочной и доступной краской для шелковых и шерстяных тканей. И добились своего: в течение почти ста лет модницы и модники Парижа, Лондона и других городов щеголяли в красивых желтых нарядах.
А после — грянул гром.
Правда, грянул он не сразу. Сначала было изобретение Н.Н.Зининым промышленного способа синтеза анилина, открывшего дорогу дешевым синтетическим красителям. Затем военные круги одного из государств Европы — Франции — обратили внимание на подлинный норов пикриновой кислоты и даже начали использовать ее в качестве разрывного заряда артиллерийских боеприпасов. Затем в 1873 г. Герман Шпренгель (любопытно, что «шпренген» по-немецки означает «взрываться», но в данном случае это чисто случайное совпадение) открыл способность пикриновой кислоты взрываться от гремучертутного капсюля-детонатора, ранее изобретенного Нобелем, и для нее мгновенно нашлось новое применение: ею стали снаряжать снаряды.
Реакция горения пикриновой кислоты в замкнутом объеме выглядит так:
2 C6H2(NO2)3OH = CO2 C 10 CO 2 H2O H2 3 N2
Начать отсчет применения пикриновой кислоты как ВВ можно с 1886 г. Во Франции она использовалась под названием мелинит, в Англии — лиддит, в Италии — пертит, в Японии — шимозе.
На то время пикриновая кислота была самым сильным и, не смотря на очевидные недостатки, самым распространенным бризантным ВВ. Однако объем производства пикриновой кислоты уже в начале ХХ в. начал уменьшаться вследствие таких ее отрицательных свойств, как взаимодействие с оболочкой снаряда, приводящее к образованию высокочувствительного к удару пикрата железа, и непригодность для приготовления аммонитов. Возможно, тротил и заменил бы пикринку, если бы не грянувшая мировая война. Отлаженная технология позволила наладить выпуск снарядов в огромных количествах [15].
Пикриновая кислота, как это ни странно звучит, была первым в истории безопасным при стрельбе взрывчатым веществом. Американские снаряды долгое время комплектовались исключительно «пикринкой».
1. Чувствительность: при испытании грузом 10 кг и высотой падения 25 см количество взрывов 24-32%.
2. Энергия взрывчатого превращения — 4020 кДж/кг.
3. Скорость детонации: 7350 м/сек.
4. Бризантность: 17 мм.
5. Фугасность: 310 куб. см.
О чувствительности пикриновой кислоты надо сказать отдельно. Сама по себе она обладает не очень высокой чувствительностью, что и привлекло к себе внимание (особенно на фоне тринитроглицерина). Однако слово «кислота» в ее названии — не только дань химической принадлежности этого вещества. Дело в том, что по сравнению с прародителем-фенолом, «пикринка» имеет довольно высокий показатель константы диссоциации. Не вдаваясь в подробности теории электролитической диссоциации и равновесия в растворах, отметим только тот факт, что по своей силе она приблизительно в 1000 раз более сильная, чем уксусная и в 20 раз более сильная, чем фосфорная.
Взаимодействие кислоты с металлами всегда заканчивается одинаково: получаются соли, в данном случае, пикраты. А вот у них с чувствительностью к внешним воздействиям всё было совсем не так, как у «пикринки»: они чрезвычайно взрывчаты, причем неустойчивость проявляют даже соли натрия и аммония. Что уж говорить о пикратах железа: тут уже даже незначительные примеси способны вызвать детонацию всего боеприпаса.
Вскоре пикриновая кислота предстала перед французской Комиссией по взрывчатым веществам. От всевидящего ока Марселена Бертло, взявшегося за ее изучение, не ускользнуло ничего. Было установлено, что пикриновая кислота — это мощнейшее бризантное вещество, уступающее разве только нитроглицерину, что кислорода в ее составе недостаточно и что желательно добавлять к ней какой-нибудь окислитель (только не селитру); что пикриновая кислота сама по себе относительно безопасна, но что она при хранении в неподходящих условиях образование пикратов ускоряется в десятки и сотни раз; что чувствительность пикриновой кислоты можно понизить сплавлением ее с динитронафталином. Эти исследования положили начало полному перевороту во взглядах на пикриновую кислоту. Окончательно недоверие к новому взрывчатому веществу было рассеяно работами парижского химика Эжена Тюрпена, который показал, что литая пикриновая кислота неузнаваемо меняет свои свойства по сравнению с прессованным порошком и в разы теряет свою опасную чувствительность.
Расплавленная пикриновая кислота своим янтарным цветом очень напоминает мед (по-гречески «мели»), откуда и получила одно из своих названий.
Само собой разумеется, работы Тюрпена были строго засекречены. И когда в восьмидесятые годы французы стали выпускать новое взрывчатое вещество под таинственным названием «мелинит», оно вызвало колоссальный интерес во всех странах. Ведь ударное действие боеприпасов, снаряженных мелинитом, внушает должное уважение даже в наше время. Несмотря на все предосторожности, тайна мелинита вскоре стала, однако, секретом полишинеля. Уже в 1890 году Менделеев сообщал русскому морскому министру Чихачеву:
«Что же касается до мелинита, разрушительное действие коего превосходит все данные испытания, то по частным источникам с разных сторон однородно понимается, что мелинит есть не что иное, как сплавленная под большим давлением остывшая пикриновая кислота».
В 1894 году пикриновая кислота стала производиться в России. Этим вопросом занимался С.В.Панпушко, человек незаурядных способностей и интересной судьбы. Думается, рассказ о нем заслуживает отдельной публикации.
Расцвет ее мирового производства пикриновой кислоты пришелся на годы первой мировой войны. Но к тому времени у нее появился уже грозный соперник, быстро потеснивший ее и в тылу, и на фронте.
Снаряды, доставленные на континент из США во время ПМВ первыми транспортами, вследствие действия морского воздуха, давали большое количество неполных взрывов. Вследствие этого содержимое снарядов, имевшее ярко-желтый цвет, распылялось в воздухе и люди, подвергшиеся его действию («канарейки»), проклинали пикриновую кислоту не столько за ее взрывчатую силу, сколько за едкий вкус во рту и въевшуюся краску.
Кроме динитронафталина, для снаряжения боеприпасов применяют динитрофенол и тринитрокрезол. Это позволяет снаряжать ими боеприпасы больших калибров. Применение находят сплавы из 60% пикриновой кислоты и 40% динитрофенола и из 40 % пикриновой кислоты и 60% тринитрокрезола.
Получают пикриновую кислоту из фенола. Фенол можно непосредственно нитровать лишь очень разбавленными кислотами, что технически трудно и невыгодно. Нитрование же фенола кислотной смесью, даже средней крепости, почти невозможно, так как высокая скорость реакции и, следовательно, интенсивное выделение теплоты вызывает его окисление и осмоление. Для предотвращения этих процессов синтез разбивают на два этапа. На первом этапе получают фенолдисульфокислоту, на втором — непосредственно тринитрофенол.
Процесс сульфирования сопровождается выделением воды, разбавляющей серную кислоту, и является обратимым:
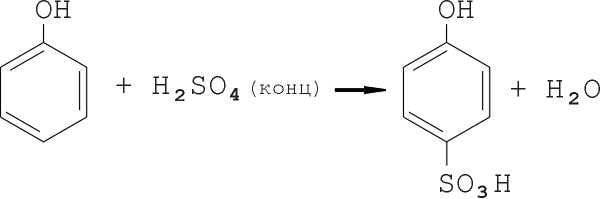
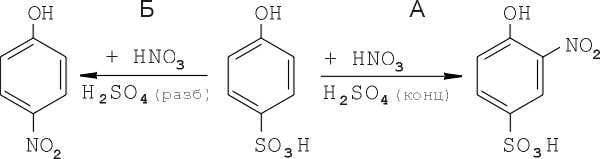
При действии на фенолсульфокислоту азотной кислотой в присутствии избытка концентрированной серной кислоты один из водородов в ядре замещается нитрогруппой (процесс А); в присутствии разбавленной серной кислоты сульфогруппа замещаются нитрогруппой (процесс Б):
Следовательно, при введении трех нитрогрупп в молекулу фенола наиболее целесообразно проводить процесс в следующем порядке. Сначала из фенола в две стадии получают фенолдисульфокислоту, затем в реакционную смесь добавляют смесь из концентрированной серной и азотной кислот:
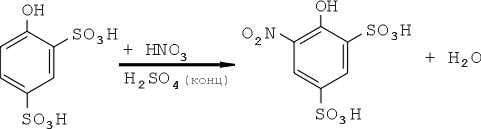
И, наконец, полученное довольно сложное соединение в среде разбавленной серной кислоты превращается в тринитрофенол:
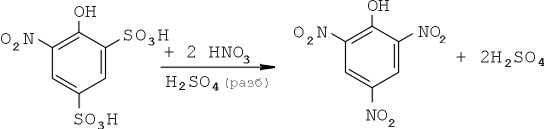
Выделяющаяся в данном случае вода — не досадная помеха, а (редкий случай!) очень существенный фактор: она разбавляет реакционную среду, автоматически регулирую концентрацию серной кислоты.
В этом случае при получении пикриновой кислоты из фенолсульфокислоты не требуется применения кислотооборота. Наиболее концентрированная кислотная смесь здесь нужна в начале процесса для введения первой нитрогруппы, в последующем нитросмесь разбавляется выделяющейся водой, что делает среду пригодной для замены сульфогруппы нитрогруппой. Нитрование протекает в наиболее благоприятных условиях — в гомогенной среде, так как сульфокислоты и их нитропроизводные хорошо растворяются в серной кислоте. В конце процесса выпадают кристаллы значительно менее растворимого тринитрофенола [5]. Полученный продукт отжимают от кислоты, промывают водой и сушат.
Синтез достаточно прост, как и синтез нитроглицерина, но при этом получающийся продукт куда как меньше подвержен риску взрыва. Температурный режим поддерживается за счет выделяемого во время реакции тепла (несомненный плюс), а концентрация кислоты автоматически поддерживается за счет разбавления образующейся воды (просто редчайшая удача — совпадение направлений двух процессов). Такая простота технологи позволила получать пикриновую кислоту в огромных количествах. Но после 10 лет применения еще в начале ХХ века пикриновая кислота была полностью вытеснена нейтральным, более удобным, и более безопасным толом. Однако, как в 1 мировую, так и во 2 мировую войны, когда не было необходимости заботиться о безопасности боеприпасов при хранении, и снаряды с завода шли прямо на передовую, производство «пикринки» возобновлялось и достигало громадных размеров. Начиная с 1943 года, когда довоенные запасы снарядов и ресурсы немцев поисчерпались, «пикринкой» стали снаряжать как мины и снаряды, так и гранаты — вместо тола.
В этом месте повествования самым уместным кажется начать рассказывать о совершенно незапланированном практическом соревновании пикриновой кислоты в своей японской ипостаси с пироксилином в качестве бризантного ВВ в ходе печально известной русско-японской войны, но автор сознательно делать этого не будет: тонны бумаги и терабайты компьютерных ресурсов, посвященных этому вопросу, так и не поставили окончательную точку в этом вопросе. Я же, пожалуй, воздержусь…
Тротил, он же тол
Пальму первенства в открытии тринитротолуола следует отдать немцам. Именно представитель Германии Юлиус Вильбрандт в 1863 г. впервые получил тринитротолуол. Дальнейшая история будущей взрывчатки развивалась более стремительно, чем у пикриновой кислоты. Уже в 1887 г. прусское военное ведомство заинтересовалось им как возможным заменителем пикриновой кислоты в артиллерийских снарядах.
Успехов у него, однако, было немного. Лишь в начале ХХ века благодаря работам немецкого инженера Г.Каста он нашёл применение в военном деле. И вот в 1902 году под официальным наименованием «FulIpuIver-2» (и неофициальным, шифрованным «тротил») технически чистый тринитротолуол был принят на вооружение германской армии в качестве начинки для снарядов малокалиберной артиллерии. И в Германии, и во многих других странах тротил считался немецким изобретением.
Во Франции полагали иначе. В России — тоже.
Сохранился один примечательный документ, позволяющий иными глазами взглянуть на историю разработки и внедрения тротила. Вот фрагменты этого документа.
Весьма секретно
НЕКОТОРЫЕ СВЕДЕНИЯ
о применении взрывчатых веществ к снаряжению снарядов в иностранных государствах
К Отчету гв. штабс-капитаиа Рдултовского о заграничной командировке в 1906 г.
Приложение № I
к рапорту № 7/1906 г.
Во время пребывания за границей в начале текущего года мне удалось собрать, независимо от возложенного на меня поручения, некоторые сведения о применении взрывчатых веществ к снаряжению артиллерийских снарядов в различных государствах.
...8. Некоторые сведения о тринитротолуоле. В бытность мою с Германии мне пришлось услышать, что в германской артиллерии испытывается какое-то новое вещество для снаряжения снарядов, известное под именем «тротил». Вскоре удалось узнать, что это условное название тринитротолуола, изготовляемого фабрикой Общества «Карбонит» близ Кельна. При посещении этой фабрики мне удалось ознакомиться в общих чертах с приготовлением «тротила», но более подробные сведения фабрика отказала мне дать, объясняя это задержкою в выдаче патента. Аналогичное объяснение я получил и на другой фабрике — Ангальто-Вестфальского общества.
...По приезде во Францию в беседе с г. Вьелем я спросил его мнение о тринитротолуоле и получил ответ, что это взрывчатое вещество само по себе очень хорошее, но что в настоящее время французские заводы не вырабатывают его исходный продукт — толуол.
...в Англии, на заводе Общества «Нобель»... выяснилось, что г. Вьель уже давно настаивает на изучении свойств и способов фабрикации высших нитропроизводных...»
Отметим один существенный момент: неугомонный Вьель, неоднократно пытавшийся получить патенты на получение ВВ (рассказ о нем, как и многих других действующих лицах этой истории, заслуживает отдельной публикации, которая будет подготовлена автором, если читатели выскажут желание с ней ознакомиться), уже знал о заменителе ПК и пытался его внедрить в производство. Основной проблемой он видел отсутствие в достаточном количестве исходного сырья, но, думается, здесь он немного лукавил — проблем с производством тротила хватало, и они только начинали вырисовываться.
А бороться было за что. Характеристики тринитротолуола (ТНТ) были довольно впечатляющими:
1. Чувствительность: к удару, трению, прострелу пулей, огню, искре, химическому воздействию не чувствителен (4-8 % взрывов при падении груза 10 кг с высоты 25 см).
2. Энергия взрывчатого превращения — 4228 кДж/кг.
3. Скорость детонации: 6900 м/сек.
4. Бризантность: 19 мм.
5. Фугасность: 285 куб. см.
Нет ничего удивительного в той сравнительной легкости, с которой молодому русскому офицеру удавалось вступать в беседы о тринитротолуоле и даже извлекать из этих бесед некоторые весьма полезные сведения. Как уже известно читателю, о тринитротолуоле как химическом соединении в кругах химиков и ученых-артиллеристов знали многие и много.
Так, при воздействии открытого пламени ТНТ загорается и горит желтым, сильно коптящим пламенем. Горение при атмосферном давлении выглядит так:
C7H5N3O6 = 2NO 3CO H2O 4C 1,5 H2 1,5N2 400 ккал/кг
Горение при высоком давлении протекает несколько иначе:
C7H5N3O6 = 6CO C 2,5H2 1,5N2 632 ккал/кг
Горение в замкнутом пространстве большого количества может перерасти в детонацию (теоретически, на практике это не встречается). Детонация представляет собой следующий процесс:
C7H5N3O6 = 1,5CO2 CO 2 H2O 4,5 C 0,5 H2 1,5 N2 1011 ккал/кг
Но другое дело «тротил», технический продукт развивающейся химической промышленности, пригодный для военных целей. Ни на германских заводах, ни в исследовательском центре Шпандау, где также побывал В.И.Рдултовский, ему не дали технологической информации.

Тщательно охраняемые тайны прусских арсеналов он совершенно неожиданно и целиком открыл... во Франции. Временно исполнявший здесь обязанности русского военного атташе (тогда его называли без околичностей — «военный агент») энергичный и предприимчивый капитан граф А.А.Игнатьев — тот самый, что, уже будучи генерал-лейтенантом Советской Армии, написал знаменитые мемуары «Пятьдесят лет в строю», — организовал для командированного за рубеж коллеги поездку в Бурже, центр французской артиллерийской мысли.
Французские ученые-артиллеристы тепло встретили своего русского собрата. Владимир Иосифович признавался потом родным и друзьям, что вино, которым угощали его французы, было великолепным и его просто жаль было выплескивать потихонечку в горшки с цветами. Но ведь разговор-то оказался каким захватывающим — о «тротиле»!
Раз в тысячу лет бывают такие совпадения. Ибо буквально накануне этой встречи, 30 апреля 1906 года, главный химик главной пиротехнической лаборатории в Бурже доктор химии подполковник французской артиллерии Келер получил до глубины души возмутившую его депешу из военного министерства. Депеша, как писал в своем рапорте по начальству В.И.Рдултовский, препровождала разведывательные сведения об испытываемом в широких размерах в Германии новом взрывчатом веществе «тротиле», а также образчик этого вещества. Министерство рекомендовало тщательно оценить сведения о новом немецком изобретении. Но это было выше моральных сил руководителя главной пиротехнической лаборатории.
«Это не немецкое изобретение, — кричал основательно захмелевший Келер русскому коллеге, — вы понимаете, штабс-капитан, не немецкое! Это достижение Франции!»
Как вы понимаете, в такой обстановке нетрудно было побудить взбешенных хозяев дать соответствующие разъяснения. Изрядно распетушившийся Келер, не долго думая, выложил внимательно и сочувственно слушавшему его иностранному офицеру всю имеющуюся у него информацию о своем приоритете в области открытия тринитротолуола и о бесплодных попытках заинтересовать им военное министерство Франции. В заключение несколько сникший химик высказал надежду, что теперь руководство армии обратит внимание на его разработки «хотя бы теперь, когда он, может быть, уже принят в Германии...»
О многом узнал в тот вечер Рдултовский. И о том, что французский химик еще в 1895 году начал широкие опыты с ТНТ. И об успехах в лабораторном синтезе ВВ, а заодно, и о некоторых характеристиках процесса. И о косности военного руководства, не желавшего что-либо менять. И о вездесущей немецкой разведке, регулярно выкрадывавшей у него записки. Но было и ещё одно, что особенно насторожило улыбчивого и внимательного штабс-капитана: Келер сообщил, что с 1905 года немцы начали широчайшие опыты по применению тротила в снарядах для тяжелой артиллерии. Прежде никому не удавалось использовать мощное взрывчатое вещество для снаряжения крупнокалиберных снарядов к пушкам и гаубицам (проблемах, с которыми столкнулись технологи при использовании ПК и НЦ, рассказывалось ранее). Полученная информация позволяла сделать вывод, что немцам удалось получить если не идеальное, то достаточно удобное и эффективное ВВ.
Сведения, полученные В.И.Рдултовским, были незамедлительно доставленные в Россию и легли в основу принятого в июне 1906 г. постановления о проведении всесторонних и полномасштабных опытов по производству и применению тротила в русской армии и флоте. Дальнейшая, полная драматизма и проблем, неудач и успехов история русского тротила — тоже предмет отдельного исследования. Мы же сделаем ещё одну заметку: уже в 1907 г. было принято решение о всеобщем внедрении тротила, а в 1909 г. началось промышленное производство этого ВВ. остальные страны перешли на него только в 1911—1918 гг.
В чем же скрывался подвох? Как всегда, в переводе процесса из лаборатории в промышленные цеха. Как и большинство других процессов, нитрование толуола проходит в три стадии. На первой стадии происходит получение мононитротолуола:
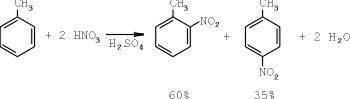
Процесс занимает около часа в реакционной смеси следующего состава: серная кислота — 55%, азотная кислота — 28% (количество азотной кислоты должно составлять 105% от теоретически необходимого).
Продукт реакции — мононитротолуол, светло-жёлтая жидкость с температурой плавления 5°С. Выход мононитротолуола составляет 95% от теоретически возможного.
Вторая стадия — получение динитротолуола в нитрующей смеси состава: серная кислота — 67%, азотная кислота — 23%.
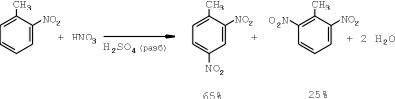
На этот раз количество азотной кислоты, взятой на нитрацию, должно составлять 200% от теоретически необходимого, а время на процесс — около 2,5 часов.
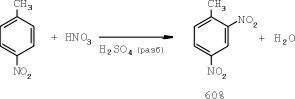
И, наконец, третья стадия — получение непосредственно самого тринитротолуола (ТНТ):
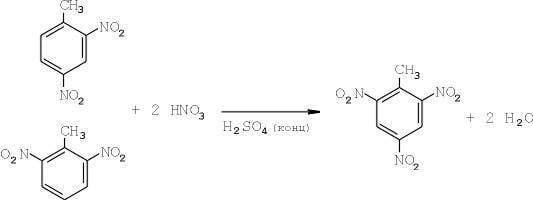
Используется нитрующую смесь состава: серная кислота — 83%, азотная кислота — 17% [2, 17].
Время на процесс — около 1,5 часа. Избыток азотной кислоты на этой стадии составляет 100% от теоретически необходимого. Выход готового продукта — до 90% [2,3, 17].
Чем же тротил отличается от пикриновой кислоты? По основным характеристикам, практически ничем: некоторые параметры выше, некоторые — ниже, но все различия, в общем-то, в границах статистической погрешности (табл. 1).
Таблица 1
—-----------------------------------------------------------------------------------------------------------------------------------------------
ВВ......Чувствительность.....Энергия взрыва...Скорость детонации....Бризантность...Фугасность
—-----------------------------------------------------------------------------------------------------------------------------------------------
ПК.......10/25/24-32....................4020..................7350.........................17...................310
ТНТ......10/25/4-8.......................4228..................6900.........................19...................285
—-----------------------------------------------------------------------------------------------------------------------------------------------
Но вот с чувствительностью дело обстоит гораздо интересней. И если проблемы с пикриновой кислотой уже стали хрестоматийными (снова позволю себе напомнить — только напомнить, не более! — дискуссию «пироксилин VS шимоза» и прочее), то тротил этих недостатков был лишен напрочь: 4-8% — это не просто статистика, это практически гарантия безопасности обращения с боеприпасами.
А как обстоят дела с технологичностью процессов? С первого взгляда, никакой разницы по сравнению с нитрованием фенола нет. Однако при более внимательном рассмотрении видно, что если в первом случае концентрация нитрующей смеси регулируется почти автоматически, то в данном случае такой роскоши нет. А это означает простой и печальный факт: каждый из полупродуктов необходимо выделять и проводить процессы в новых реакционных смесях.
Разделение веществ из смесей — один из самых нелюбимых химиками процессов. По энергозатратам и трудоёмкости он требует, как правило, в десятки и сотни раз больше усилий, чем смешение (классический пример — задание Золушке, выданное коварной мачехой). Время производства и стоимость продукта возрастают многократно, масштабы производства — тоже. Растворимость нитропроизводных толуола в воде очень низкая, но из всех трех продуктов только монопроизводное (первая стадия) является жидкостью легче воды, что облегчает его выделение. Ди- и тринитропроизводные — твердые вещества и их отделение от водной фазы требует выдерживания смеси до 90 — 100 С. Давайте вновь обратимся к сравнительной таблице.
Таблица 2
—--------------------------------------------------------------------------------------------------------------
ВВ.....Расход реактивов на 1кг......Количество стадий........Количество
........Азотная к-та..Серная к-та...............................выделяемых продуктов
—--------------------------------------------------------------------------------------------------------------
ПК.........1,4.................2,8.......................3...........................1
ТНТ........3,9.................6,3.......................3...........................3
—--------------------------------------------------------------------------------------------------------------
Как видно, при сравнительно равных боевых характеристиках обоих ВВ, производственные параметры явно были не в пользу тротила. Решить эту проблему могли только государства, у которых были в наличии два фактора: развитая химическая промышленность и относительно небольшие запасы накопленной к тому времени ПК.
Как связывали азот
Итак, ситуация стала предельно ясной: производить мощную взрывчатку могут только страны, имеющие большое количество дешевой азотной кислоты и высокоиндустриальное химико-технологическое производство. Безусловными лидерами в этом отношении на вторую половину XIX века являлись Англия, Франция и Германия. И тут первая мировая война началась значительно раньше, чем прозвучали роковые выстрелы в Сараево.
Проблемой связывания азота (так в химической технологии называют комплекс процессов превращения атмосферного азота в азотную кислоту и ее соли) химики были озадачены давно. Решить ее двумя путями.
Первый заключался в прямом окислении азота кислородом:
N2 O2 — 2 NO
Далее все выглядело просто: сначала оксид легко превращался в диоксид
2 NO O2 = 2 NO2
который также легко поглощался обогащенной кислородом водой с получением азотной кислоты:
4 NO2 2 H2O O2 = 4 HNO3
Кислота из воздуха и воды — сам Аристотель позеленел бы от зависти. Казалось, что проще: находим подходящую речку с бурным потоком, строим единый комплекс из гидроэлектростанции и завода по производству азотной кислоты и — вуаля, проблема решена. Но не всегда то, что просто выглядит на бумаге, так же легко протекает в жизни.
Как известно, дьявол прячется в деталях. В данном случае такой деталью стал значок — — один из самых нелюбимых химиками символов. Он обозначает тот печальный факт, что реакция находится в состоянии динамического равновесия и в каждый момент времени количества образующихся и распадающихся молекул одинаково. Причем достигается состояние равновесия очень быстро: при содержании окиси азота около 2-3%. Предотвратить эту неприятность можно, только охладив реакционную смесь. В лабораторных условиях удавалось реализовать такой подход, но в промышленных условиях конечный выход продукта оставался удручающе низким. Второй проблемой на пути реализации прямого окисления азота стал слишком большой расход электроэнергии: на 1 тонну продукта расходовалось 70 тыс. кВт-ч, причем только 3% этой энергии расходовалось на получение продукции. В общем, атмосферный азот казался неприступным, как спальня королевы.
Но, как известно, неприступных твердынь не бывает: если не удается прямой штурм, всегда можно найти обходной путь. Таким маневром в вопросе связывания азота стала реакция окисления аммиака:
4 NH3 7 O2 = 4 NO2 6 H2O
Однако зловредность природы заключалась в том, что источника аммиака в природе тоже не существует, хотя компоненты для его поучения — те же (вода и воздух) и имеются в неограниченном количестве в любой точке планеты.
Парадокс, но получение водорода электролизом воды, синтез аммиака и его окисление в дуге электрического разряда — такой окольный путь оказался действительно экономически и технологически выгодней и дешевле, чем прямое окисление азота.
Синтез аммиака — реакция тоже обратимая, но равновесие наступает при содержании аммиака порядка 30%. И хотя она тоже требует применения нагревания и повышения температуры, ее условия можно существенно изменить в сторону облегчения процесса.
И вот тут-то мы сталкиваемся с одной из самых романтичных страничек в борьбе химиков, предшествовавшей столкновению генералов. На сцене появилось еще одно действующее лицо — катализатор. Именно эти замечательные вещества, названные Вант-Гоффом «волшебной палочкой химии», позволяют кардинально влиять на химические процессы.
Поиск и адаптация катализаторов — задача не из легких. Зачастую эта работа может занять несколько лет, и никто не может заранее гарантировать успех.
В Германии эта проблема была поднята на самый высший уровень: сам кайзер лично курировал проект поиска катализатора. Вопрос решался с немецкой обстоятельностью и пунктуальностью. Перед химиками была поставлена задача — ни много, ни мало, а разработать теорию действия катализаторов и на ее основе найти наиболее эффективный для реакции получения аммиака. На эти работы выделялась немыслимая по тем временам сумма — 100000 марок, и ставился срок в два года. Но два года напряженной работы закончились неудачей. Тогда кайзер вторично выделяет из казны 50000 марок и дает задание за один год найти подходящий катализатор опытным путем. Со свойственной немцам педантичностью ученые перебрали около 250 тысяч различных материалов: простых и сложных веществ, смесей и сплавов, жидкостей, твердых веществ и газов. Найденный ими в 1908 году катализатор — сплав платины с иридием или родием — несмотря на то, что сейчас найдены более дешевые аналоги, до сих пор исправно трудится на многих химических предприятиях (забегая вперед, скажу, что немецкие химики Фриц Габер в 1918 году и Карл Бош, который значительно усовершенствовал этот процесс, в 1931 году, получили за свои исследования Нобелевские премии).
Но это все было потом, после Версаля и нового витка милитаризации Германии. А тогда Германия хранила свой секрет не хуже, чем крестоносцы Святой Грааль. Работы по синтезу аммиака переносятся из лабораторий в Карлсруэ на Баденскую анилиново-содовую компанию (именно там к работам и подключился К. Бош). В 1910 году БАСФ полностью отработала и внедрила технологию получения аммиака и азотной кислоты; в 1913 году была построена фабрика в Оппау, уже в ходе войны — в Лейне. В начале второго десятилетия ХХ века немецкие фабрики полностью покрыли потребности арсеналов во взрывчатке и фермеров в азотных удобрениях. В случае мобилизации фабрики могли выдать колоссальные объёмы взрывчатки и порохов, необходимых для крупномасштабной войны. И всё это без поставок извне, исключительно на отечественном сырье (как известно, воздух везде отечественный). Чилийцы считали убытки, английские адмиралы нервно курили в сторонке — их броненосные эскадры уже не были гарантом мира во всём мире (точнее, английского миропорядка). А в это время в Потсдаме генералы планировали завоевание мира (очередное головокружение от успеха). Теперь благодаря Габеру потребная для войны взрывчатка имелась в неограниченном количестве.
В нашем мире все взаимосвязано. И почти ничто не является само собой разумеющимся. Кроме, пожалуй, одного: непреходящей важности науки. Автору не хочется выглядеть тем записным куликом, во все горло расхваливающим родное болото, но изучение истории мира и истории науки убеждает его, что страны, руководство которых уделяло внимание развитию фундаментальных наук, не требуя от них немедленного практического эффекта, всегда в результате получало выгоду в виде быстрого решения насущных проблем. И химии, как одной из древнейших и удивительнейших наук, принадлежит одно из лидирующих мест.
А азот и его соединения не получили отставки после перехода на тротил. Более того, сегодня, по мере постепенного отказа от некогда столь популярного тола, они исправно укрощают дьявола взрывчатки в еще более мощных ВВ: гексогене и октогене. А недавно в печати появились сообщения о синтезе нового бризантного ВВ, претендующего на вхождение в элитный список самых популярных взрывчаток мира. Речь идет о гексанитрогексаазаизовюрцитане, известном под коммерческим именем CL-20. Его молекула является шедевром синтетической химии, представляя ажурную конструкцию из двух пятиугольников, в которых атомов азота больше, чем атомов углерода.
Так что военная история азота и нитратов продолжается…
Литература
1. http://wap.alternativa.borda.ru/?1-5-120-00000316-000-0-0-1140073895.
2. http://www.pirotek.info/VV/Sintez_TNT.html.
3. http://www.exploders.info/sprawka/40.html.
4. ХиМиК.ru. http://www.xumuk.ru/encyklopedia/2/4574.html.
5. http://rudocs.exdat.com/docs/index-34762.html?page=17.
6. http://army.armor.kiev.ua/engenear/dinamit.shtml.
7. http://www.pirotek.info/Vv2/nitroglicol.htm.
8. http://www.exploders.info/sprawka/91.html.
9. А. Штетбахер. Пороха и взрывчатые вещества. Москва: ОНТИ — Главная редакция химической литературы, 1936.
10. Л.В. Дубнов, Н.С. Бахаревич, А.И. Романов. Промышленные взрывчатые вещества. Москва, «Недра», 1988.
11. Ф. Наум. Нитроглицерин и нитроглицериновые взрывчатые вещества. Москва — Ленинград: Государственное химико-техническое изд-во ОНТИ, 1934.
12. http://war.newru.org/news/dinamitnye_pushki_zalinskogo/2012-11-24-88.
13. http://piterhunt.ru/pages/nk-os/3/3.htm.
14. Станицын В. Порох // Химия и жизнь. 1975. №10. С. 48-54.
15. http://igor-grek.ucoz.ru/publ/tekhnologii/vzryvchatka_pikrinovaja_kislota/7-1-0-156.
16. http://dic.academic.ru/dic.nsf/ruwiki/104953.
17. Демидов В.И. Горький мед — «мелинит» // Химия и жизнь. 1974. №8. С 61-65.
18. Орлова Е.Ю. Химия и технология бризантных взрывчатых веществ. 3-е изд. перераб. Л.: Химия, 1981. 312 с.
Источник: http://topwar.ru